医疗器械香港注册全攻略,快速通往香港市场!
发布时间:2025-01-16
作者: grzan
浏览量: 88
近年来,随着医疗技术的不断进步和人们对健康需求的日益增长,医疗器械市场在全球范围内都呈现出快速增长的趋势。香港作为亚洲重要的医疗器械市场之一,也吸引了越来越多的国内外企业和产品进入。
近年来,随着医疗技术的不断进步和人们对健康需求的日益增长,医疗器械市场在全球范围内都呈现出快速增长的趋势。香港作为亚洲重要的医疗器械市场之一,也吸引了越来越多的国内外企业和产品进入。
监管机构
香港医疗器械的监管机构是卫生署医疗仪器科(MDD)。
任何医疗仪器 (第I级一般医疗仪器或第A级体外诊断医疗仪器除外) 进入香港市场,自愿向医疗仪器科申请把仪器纳入“医疗仪器列表”,符合规定的仪器会纳入列表并公示,仪器表列的批准或有条件批准将有效5年。
产品分类
医疗仪器行政管理制度采用了国际医疗器械监管机构论坛(IMDRF)公布的分级规则。
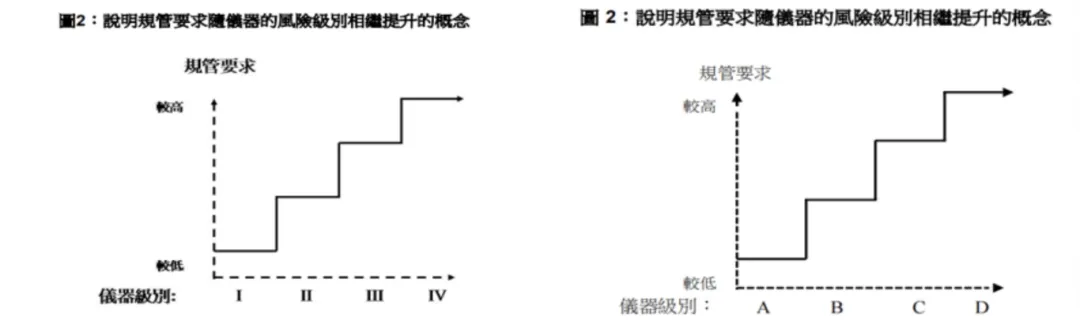
把一般医疗仪器分为4级(第I、II、III及IV级)。第IV级为风险最高的级别,第I级为风险最低的级别。
体外诊断医疗仪器分为4级(第A、B、C及D级)。第D级为风险最高的级别,第A级为风险最低的级别。
文件清单
制造商详细信息
本地负责人详细信息
产品技术文件,性能要求,分类依据,体系文件等
产品已有的其他国家注册证书(如有)
医疗仪器符合基本原则核对表
注册流程
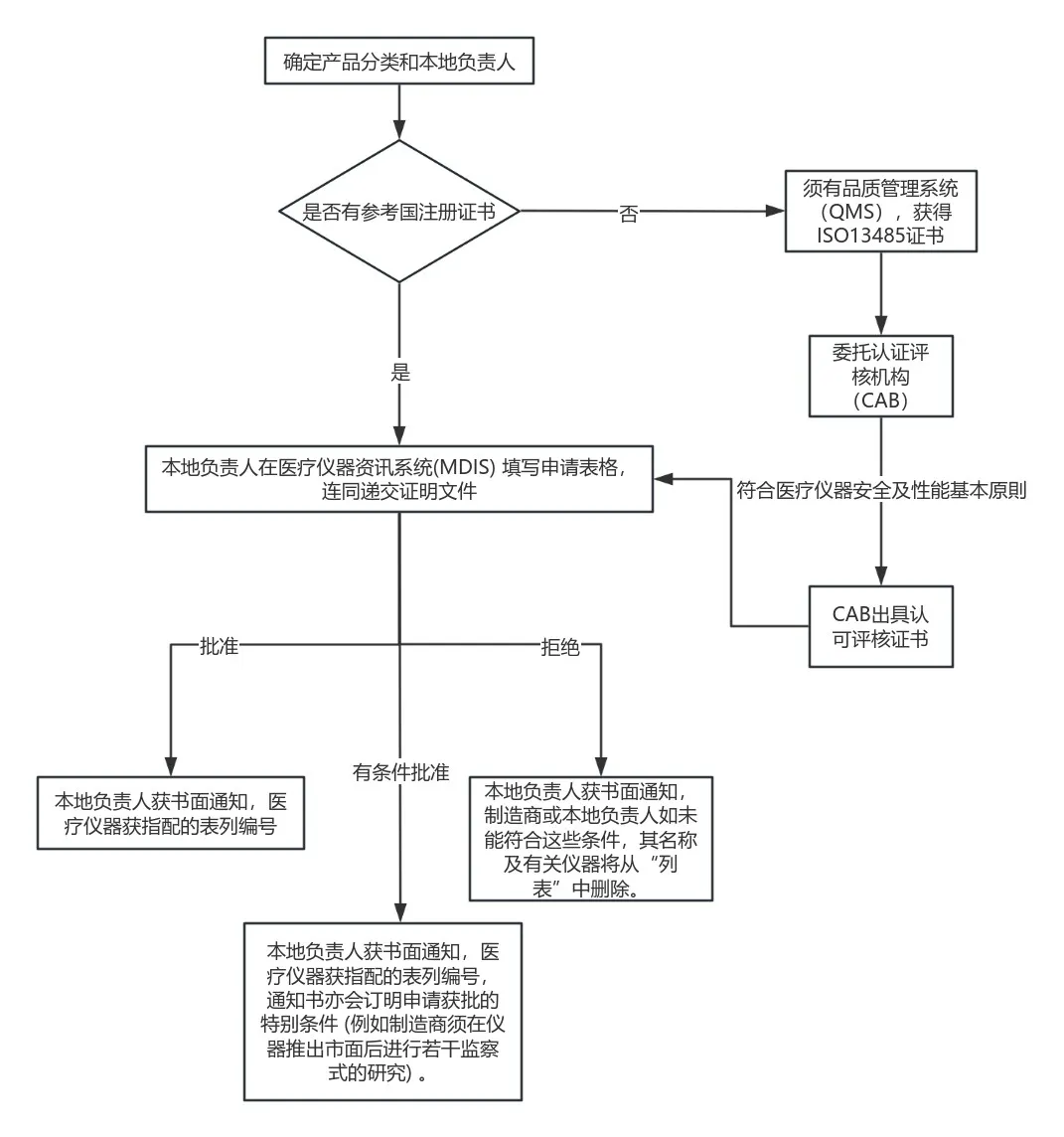
若产品已获得澳洲、加拿大、欧盟、日本、美国、中国、南韩、新加坡的注册证书,可简化注册流程。
周期
预计周期4-6个月,时间因申请资料完整性及香港卫生署医疗仪器科审核效率而异。
更新
向医疗仪器科提交表列医疗仪器的改动申请表格,收到改动申请后,医疗仪器科若批准,本地负责人会收到通知,如果需要更新表列证书,本地负责人须将现有表列证书的正本退还予医疗仪器科以作更换。
延续
本地负责人须在5年有效期届满前最少12周,向医疗仪器科递交延续表列的申请。延续表列的申请必须在上述期限内交予医疗仪器科,否则5年有效期届满后仪器可能会被除名。
有相关产品注册需求的企业可联系国瑞中安团队。
上一个:
越南医疗器械市场准入要求
下一个:
欧盟自由销售证明办理流程详解


