Coronavirus Test Device Approvals,简称CTDA,是英国政府针对新冠检测试剂颁发的法规。相关企业需注册并通过CTDA批准程序后才可以在英国销售新冠检测产品。

近期,IVDEAR团队收到了较多企业申请英国CTDA的注册咨询。IVDEAR团队也特地对此进行了一番解读,详情见此篇文章:关注:新冠抗原检测试剂盒自测版英国CTDA申请解读。
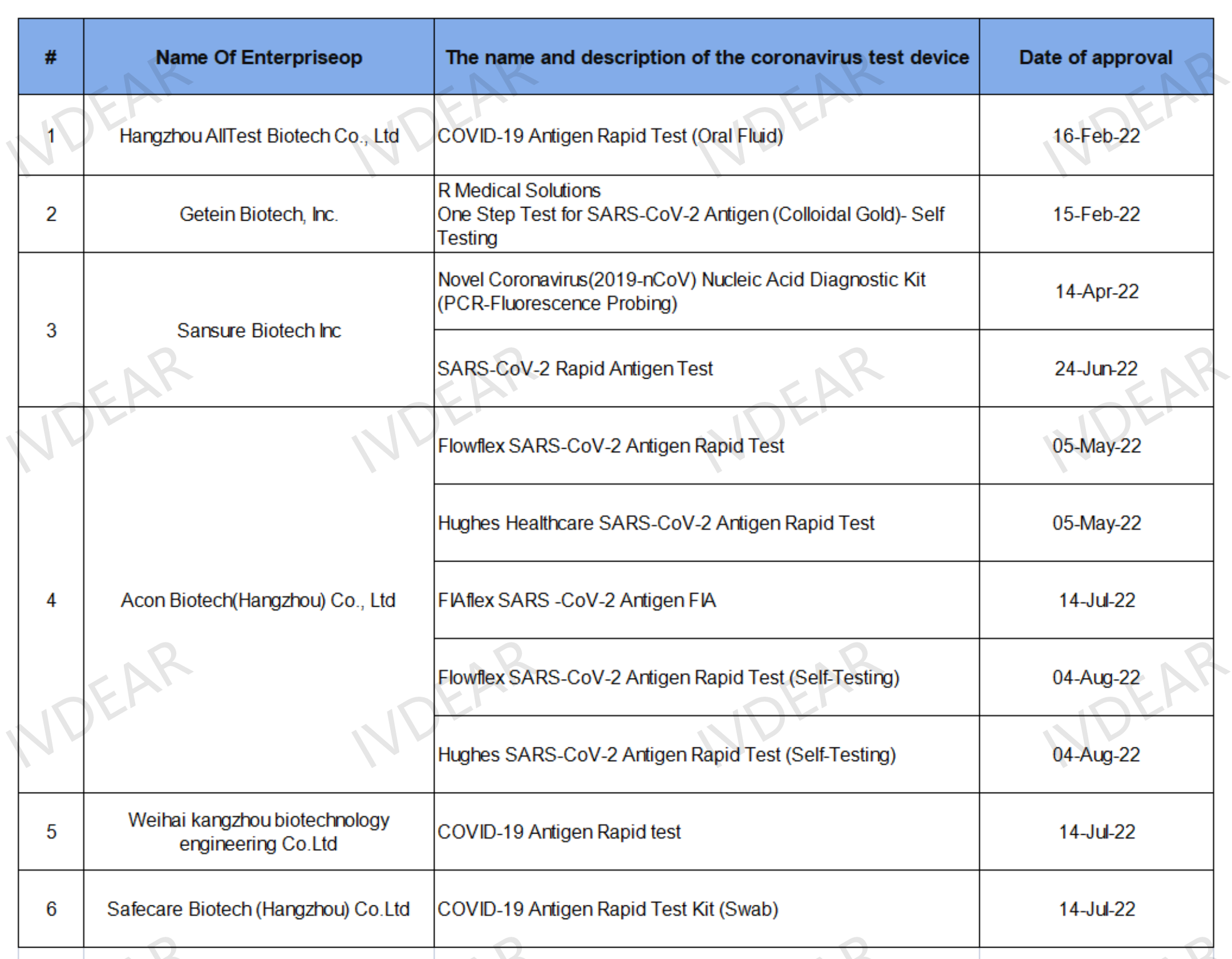
英国CTDA注册的申请难度较高,因此,目前新冠试剂盒(自测)已获得CTDA注册的中国企业并不多。通过审核的企业将会被列入已获批准名单并在官网上进行公示,有效期为5年,查询链接:https://www.gov.uk/government/publications/covid-19-test-validation-approved-products
截止2022年8月18日,新冠抗原自测试剂已获得英国CTDA的中国企业仅七家,分别为:奥泰生物、基蛋生物、圣湘生物、艾康生物、康州生物、赛凯生物。
由此可见,CTDA资质目前依然具有一定的稀缺性。IVDEAR团队建议企业可进行CTDA注册,布局英国抗原自测市场。
CTDA注册具备一定的申请门槛,部分企业可能达不到申请条件的要求。企业必须持有CE 或UKCA 或MHRA。如不符合此要求,申请将被自动拒绝。
企业申请CTDA,对于临床也有一定的要求。临床性能验证阳性样本至少100例,建议最好150例,其中CT <25 占比10%~40%;CT 25 to 30 占比至少10%;CT >30 占比至少20%),且PCR 参考试剂灵敏度须大于97%(95% CI)。
目前已获得抗原自测CE认证证书的企业可考虑申请CTDA,IVDEAR团队可为企业提供CTDA注册申请的全方位服务,有需进一步了解该项目的企业可与我们取得联络。


