幽门螺杆菌感染是人类最常见的慢性感染之一,在全球自然人群的感染率超过50%。1994年世界卫生组织所属国际癌症研究中心(IARC)已将幽门螺杆菌列为第一类生物致癌因子。
什么是幽门螺杆菌?
幽门螺杆菌(以下简称HP)是一种革兰氏阴性菌,主要定植于人的胃黏膜,人是它的唯一宿主和传染源,幽门螺杆菌存在于人的唾液,牙菌斑和粪便中,主要是通过粪口和口口途径进行传播。
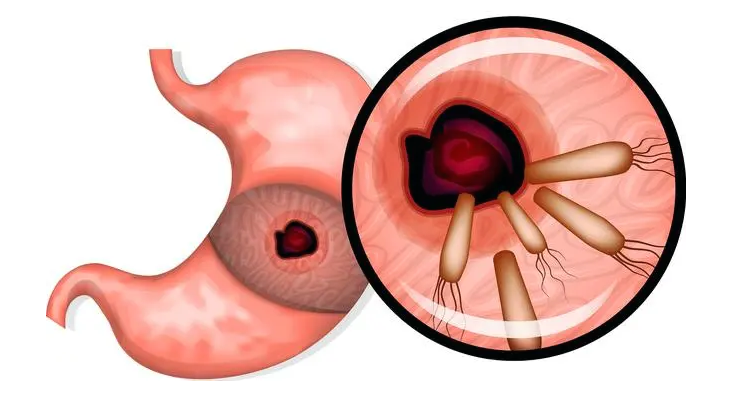
感染幽门螺杆菌后一般很难自行清除,如果不使用药物治疗常常会终身感染,或胃黏膜发生严重的肠化生时幽门螺杆菌难以在上面定植时,才会自动消失。
HP早筛的重要性
幽门螺杆菌与慢性胃炎、胃十二指肠溃疡等胃部疾病的发生密切相关,及早检测并根除幽门螺杆菌可显著减少胃和十二指肠疾病包括胃癌的发病率,并可在未来减少幽门螺杆菌感染的新发病例。
年度体检往往会建议进行幽门螺旋杆菌的检测,一旦发现感染可及早进行治疗。也可根据自身实际需要进行自测。
HP检测方式
幽门螺杆菌感染的诊断方法依据取样方式分为两大类:侵入性检测和非侵入性检测。
侵入性检测是指依赖胃镜取材的检测方法,包括组织学检测、细菌培养、快速尿素酶试验(RUT)以及幽门螺杆菌核酸检测;
非侵入性检测包括血清学(抗体)检测、粪便幽门螺杆菌抗原检测或基因检测以及尿素呼气试验(UBT)等。
不同诊断方法有各自的优势和局限性。
来自国际市场调研公司“The Insight Partners”在2022年8月24日发布的HP无创检测试剂全球市场调研报告显示:

2021年,全球幽门螺旋杆菌非侵入式检测市场规模5.96亿美元;预计2028年non-invasive的市场规模达到8亿美元,年复合增长率达到4.4%。
国际HP检测市场主要参与品牌:
· Thermo Fisher Scientific(美国)
· Quest Diagnostics incorporate(美国)
· Meridian Bioscience(美国)
· Bio.Rad Laboratories(美国)
· CerTest BIOTEC(西班牙)
· Biomarica(美国)
· Otsuka (日本)
· Avanos Corporate(美国)
· Biohit (芬兰)
· BioMerieux SA(法国)
· Cardinal Health(美国)
在IVDR法规下,如何顺利获得幽门螺旋杆菌检测试剂CE-IVDR证书?
幽门螺杆菌(HP)检测试剂想要获得CE-IVDR证书的基础必然是依照并满足法规(IVDR法规、ISO20916、临床GCP等法规)的要求才可能最终实现获证。
IVDR法规将体外诊断产品划分为A、B、C、D四个风险等级,制造商对于产品的预期用途决定了产品所属分类。HP自测试剂常见预期用途是检测幽门螺杆菌以防止或确诊癌症的发生,符合C类所包含的规则3(h):to be used in screening, diagnosis, or staging of cancer(用于癌症的筛查、诊断或分期),属于Class C。另外,作为自测试剂符合Rule4也是属于Class C。
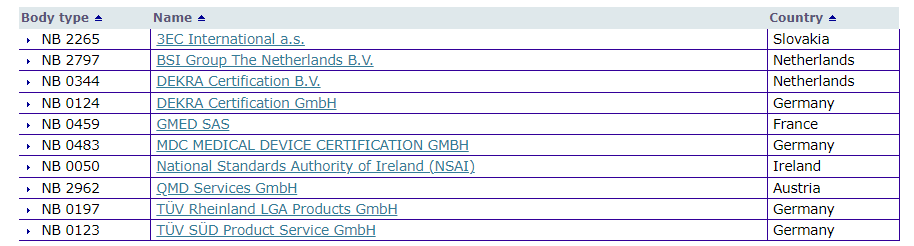
已获得IVDR认证资质的公告机构
由于公告机构资源与审核老师数量有限,以及欧盟暂未有获批的参考实验室,且IVDR总体的审核发证时间也较为漫长,目前大多数公告机构都无法大量受理IVDR的认证申请。
临床性能资料作为IVDR整体技术文件不可或缺的一部分,企业应优先解决产品的临床性能研究以及可用性研究,且应同时准备技术文件,在获得公告机构受理名额后,方可第一时间提交完整的技术文件供公告机构审核。
1.不同样本类型的取样方式
对于抗原检测试剂,样本类型通常为粪便样本。
对于抗体检测试剂,可能涉及血清/血浆/尿液等不同样本类型。
对于尿素呼气试验(UBT),需要提前服用含C13或C14尿素胶囊,若被测者感染幽门螺杆菌,其可分泌尿素酶将尿素分解为NH3和CO2,通过吹气试验测量呼出的含碳14标记的CO2含量来推断感染情况。
2.临床样本的选取要求
由于幽门螺杆菌菌株间差异较大,不同地域、不同人群感染的菌株在基因特征和抗原表型上可能有明显不同,所以应当使用不同地域临床菌株和临床阳性样本进行检测,避免菌株之间的差异造成假阴性。
对于抗体检测试剂,应选择来源于不同地域、不同人群的多份临床确诊为幽门螺杆菌抗体阳性的患者样本进行研究。
3.入组病例标准
入组病例可包括有胃炎、消化性溃疡、消化不良等胃部疾病人群,以及部分无相关症状但临床怀疑幽门螺杆菌感染的人群。针对HP自测试剂的临床性能研究对比方式,一般如下:
(1)与已上市同类产品进行对比试验;
(2)与临床参考标准尿素呼气试验 (UBT)进行比较研究;
(3)laymen可用性研究方面,应招募无医学背景的受试者与专业检测人员,使用检测试剂进行采样测试并比对结果;还需招募无医学背景的受试者对说明书的认知能力以及产品的判读使用进行研究评价。
通过比对后确认考核试剂的阳性符合率、阴性符合率、灵敏度、特异性,再将结果不一致的样本与其他已上市同类产品或者临床确认/参考标准进行验证并进行原因分析。
交叉反应验证是HP自测试剂性能指标的一个重要项:
与幽门螺杆菌具有同源性的近缘菌或者易引起相似症状的菌株类别:如弯曲菌属、芽胞杆菌属、埃希菌属、肠杆菌属、变形杆菌属、白色念珠菌、肠球菌属、克雷伯菌属等应进行交叉反应验证并对结果进行判断是否为阴性。
4.样本数量参考
目前欧盟的法规或指南中,未对幽门螺旋杆菌检测试剂的临床试验所需样本量做出具体规定,IVDEAR团队联合医学实验中心与欧盟主管机构开展了方案讨论,并根据会议讨论结果对幽门螺杆菌检测试剂的阴阳性样本量等做出了合理估算和设计。

各大IVD制造商如需开展HP欧洲临床试验研究,争取最快速度获取CE-IVDR证书,欢迎垂询IVDEAR团队。
艾维迪亚团队的优势:
艾维迪亚团队具备多临床中心同时开展HP检测试剂产品的临床试验及可用性研究的条件,已制定完备的临床试验方案,从流行病学、统计学、临床医学、检验医学、病例纳入标准、病例排除标准、剔除标准、交叉反应、不一致结果分析、样本量、对比方法等多方面考虑,设计科学合理的临床试验研究方案。临床试验研究地点主要以具备全科诊疗能力的大型公立医院为主,在受试者的招募上具备一定的优势!


