近日,MDCG专家小组更新了MDCG 2020-16 (MDCG 2020-16 rev.2: Guidance on Classification Rules for in vitro Diagnostic Medical Devices under Regulation (EU) 2017/746),更新的内容如下:
Rule 3 (f) : Devices intended to be used as companion diagnostics(CDx) ;
Annex 2 : Flowchart to help determine whether an IVD is a CDx.
此次更新的重点是针对伴随诊断设备(CDx)相关方面的,也增加了如何判定CDx的流程图。那我们一起来重点研究下Rule 3(f)更新内容和Annex 2吧。
伴随诊断在IVDR Article 2(7)条中被定义为对安全有效使用相应药品至关重要的设备,能够在治疗前和/或治疗期间,确定最有可能从相应药品获益的患者,或在治疗前和/或治疗期间,识别出可能因使用相应药品治疗而增加严重不良反应风险的患者。
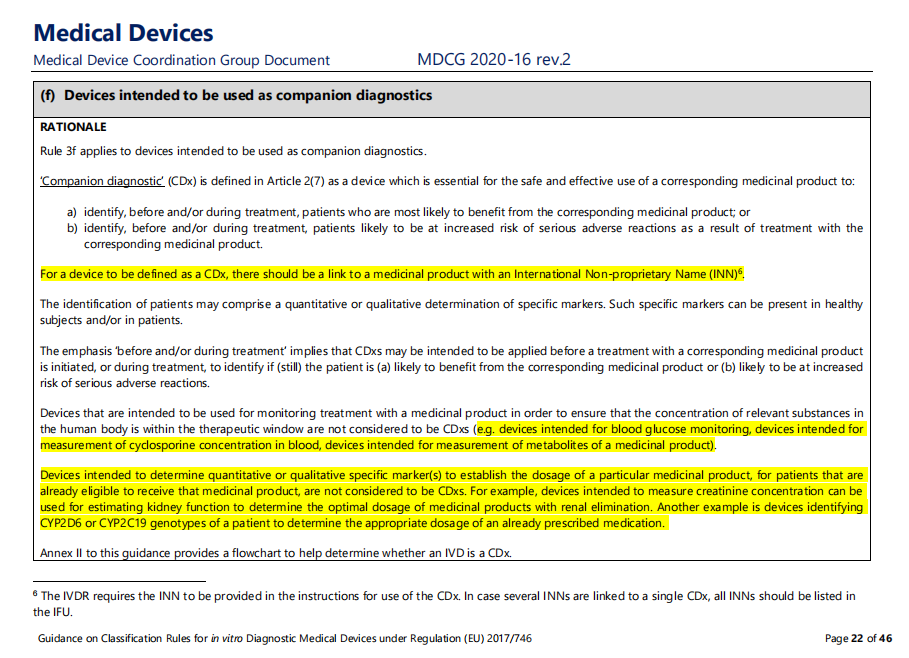
从上图可以看出,主要变更的内容为以下两点:
1. 对CDx判断增加了限制条件就是结合的药物必须具有国际非专利名称(INN)。
2. 增加不被判定为CDx的举例:
2.1 在治疗窗口期为了监测人体中相关物质浓度的设备不被认为是是CDx(例如用于血糖监测的设备、用于测量血液中环孢素浓度的设备、用于测量药物代谢物的设备)。
2.2 对于已经有资格接受特定药物治疗的患者,为了确定该药品剂量、旨在定性或定量确定特定标记物的设备,不被认为是CDx。例如旨在测量肌酐浓度的设备,用肾清除法评估肾功能以确定药物的最佳剂量。另一个例子是识别患者的CYP2D6或CYP2C19基因型的设备,以确定已有处方药物的适当剂量。
Annex 2
如何判断CDx的流程图:
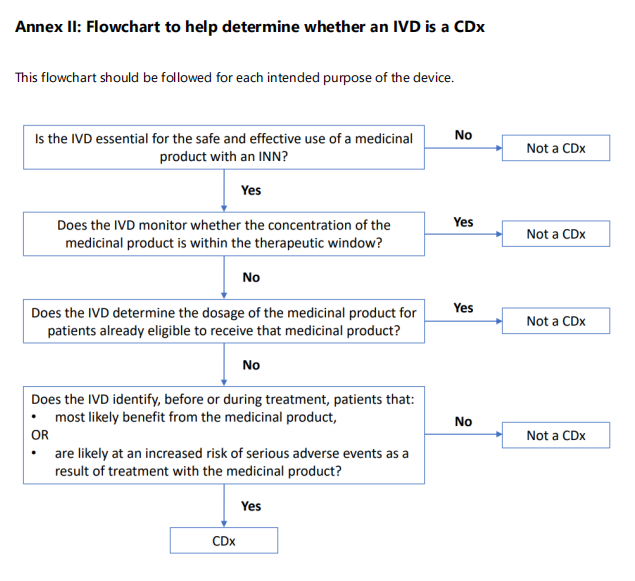
如上图所示,您可以根据这些问题来判断是否属于伴随诊断产品:
| 1 | IVD对于具有INN药品的安全有效性使用必不可少吗? | √ |
| 2 | IVD是否用于监测在治疗窗口期内的药物浓度? | ✘ |
| 3 | IVD是否用于确定已经有资格接受该药品的患者的药品使用剂量? | ✘ |
| 4 | IVD是否在治疗前或治疗期间识别出以下患者:最有可能从药品中获益,或可能增加因使用药品治疗而发生严重不良事件的风险? | √ |
如以上条件都满足,那可以确定您的产品属于CDx。


